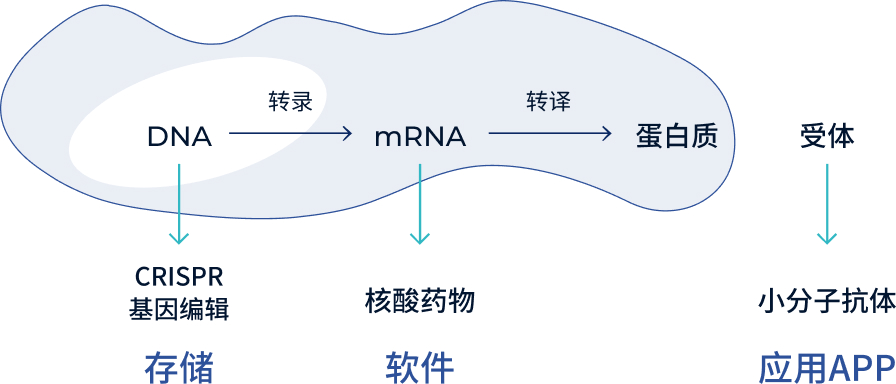
试想一种药物能像智能手机安装APP般自由升级——这正是"可编程药物"创造的医疗革命。不同于传统药物仅靠化学键被动生效,这种创新疗法通过合成生物学与AI双引擎驱动,将DNA/RNA片段编译成"基因软件",借助纳米级智能载体精准植入细胞,实现对生命程序的改写与优化。
在微观世界中,CRISPR-Cas9系统犹如精准的基因剪刀,搭载到脂质纳米颗粒(LNP)组成的"纳米火箭",就可将定制化DNA模板精准靶向递送到病变细胞核。当AI预测模型识别到特定疾病信号,预先编程的mRNA链便开始"转录-翻译"接力:核糖体工厂高效合成治疗性蛋白质,如同批量生产微型机器人,既能清除错误折叠的致病蛋白,又能激活休眠的抑癌基因。
随着科研的不断突破,未来“可编程”药物也许可以给细胞装上可编程“芯片”,“一键重启”疾病细胞回到健康细胞。科学家正在构建涵盖基因编辑、表观遗传修饰、蛋白质合成的全维度调控网络,未来或可像调试计算机代码般,为阿尔茨海默症患者重建记忆回路,为渐冻症患者激活运动神经元,真正实现疾病的个性化、数字化诊疗。
mRNA, 即信使核糖核酸(Messenger RNA),是一种携带遗传信息的分子,作为DNA和蛋白质之间的桥梁,指导蛋白质生产。理论上,科学家可以利用mRNA合成任何想要的蛋白质,来达到治愈疾病的效果。
在生命剧场中,mRNA扮演着"动态乐谱"的角色——它将DNA中静态的遗传密码翻译成蛋白质的动态交响曲。而可编程药物通过AI算法重构这段"乐谱",让mRNA化身精准的"分子建筑师",在细胞内按需搭建功能元件。
科学家利用化学修饰技术为mRNA穿上"隐形斗篷",使其避开免疫系统的追查;再通过纳米脂质体构建"纳米火箭",搭载编码特定功能蛋白的mRNA序列直抵病灶。当纳米载体感知肿瘤微环境的低氧信号时,会自动释放mRNA,指挥细胞工厂生产抗癌蛋白。
这种技术已在临床试验中展现惊人潜力:编码Cas9蛋白的mRNA与向导RNA组成"基因剪刀套装",可精准切除致病基因并替换为健康版本;针对罕见病的mRNA疗法甚至能重启胎儿期的血红蛋白合成通路,替代有缺陷的成人血红蛋白。未来,结合AI预测模型,mRNA或将具备实时感知疾病进程的能力,像智能温控系统般动态调节治疗剂量,实现真正的按需医疗。
“可编程细胞”的未来,让科学家们遥望一个没有疾病,没有衰老的世界,而通往这个世界的必经之路离不开纳米递送技术。
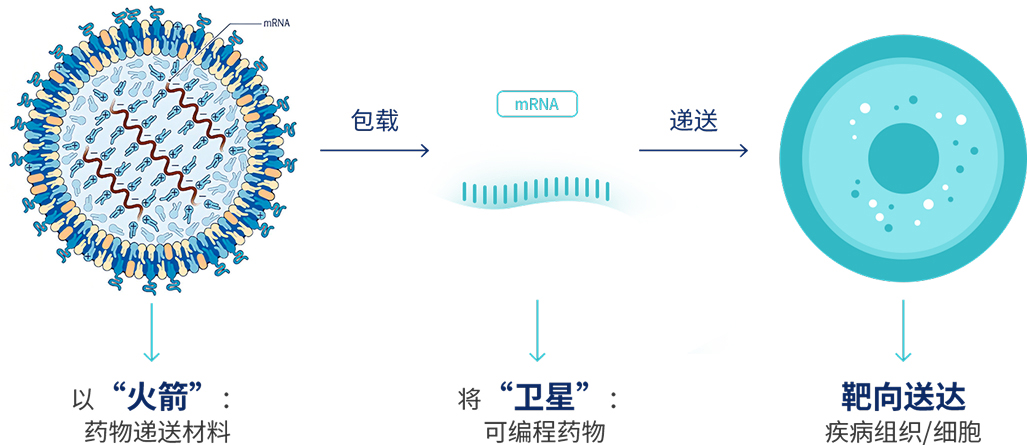
mRNA是个娇嫩的"棉花卫星",既怕核酸酶撕碎,又因负电荷无法穿透细胞膜,需要得到LNP“纳米火箭”超能力的精准护航。LNP可以为其量身打造三层防护:外层PEG脂质伪装成无害脂蛋白骗过免疫系统,中层可电离脂质化身"变形金刚",在胃酸中蜷缩成致密球体保护货物,进入细胞后遇碱性环境瞬间展开,像"分子爪"般释放mRNA。
未来的药物将以基因编码指令为核心,通过核酸药物递送系统实现疾病细胞的精准重编程。这类"可编程药物"以“火箭+卫星”的模式,要依靠特定的LNP纳米载体“火箭”,搭载mRNA或CRISPR-Cas9系统等特定遗传信息的核酸分子“包裹”,才能实现靶向递送与可控释放。
LNP的技术显著提高了mRNA的有效性和安全性,辉瑞/BioNTech与Moderna的两款mRNA疫苗均采用LNP递送,为控制全球大流行立下了汗马功劳。2022年,开创LNP药物递送工作的皮特·库里斯(Pieter Cullis)、卡塔琳·卡里科(Katalin Karikó)、德鲁·魏斯曼(Drew Weissman)获得素有“小诺贝尔奖”的盖尔德纳奖。
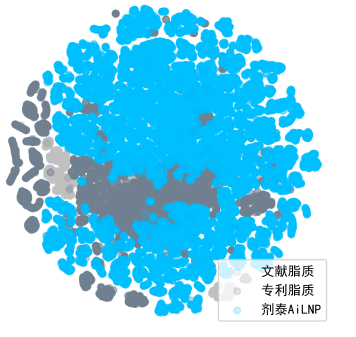
LNP(脂质纳米颗粒)通常至少有四种不同的脂质成分。每一种成分都具有独特的化学结构和不同的物理化学性质,并可以彼此独立地被优化。当所有这些可能的变量叠加时,会出现一个非常大而复杂的空间,找到最佳组合,几乎就像大海捞针。
这些关键的最优空间实际上可能是不连续和分散的,这意味着如果使用传统的DOE方法,筛选相对较小的空间有可能找到局部最优,但同时很可能错失筛选能力之外的最佳空间。图中可以看到文献或专利中所有已知的脂质,许多点倾向于聚集在一起,因为传统方法往往互相学习,互相借用前人或对方的结构。但真正引人注目的是图中间的大量空白。
从成立的第一天开始,剂泰医药就想做一些非常不同的事情。我们希望能够应用人工智能机器学习工具,然后与高通量筛选、实验平台相结合,建立传统雷达之外的蓝色大海,填满整个空间。创立5年以来,剂泰首创了AI纳米基座大模型,率先实现人工智能端到端脂质设计。相比于传统模式,AI帮助我们将纳米递送材料设计空间扩展了千倍以上。